新聞中心
北京佑安醫(yī)院聯(lián)合南加州大學KECK醫(yī)學院共同揭示線粒體自噬調控肝癌干細胞新的分子機制


北京市肝癌研究所的劉凱博士(研究員)歷經(jīng)近三年半的實驗和觀察,完成對線粒體自噬調控肝癌干細胞(LCSCs)產生的研究,,以第一作者撰寫的論著 “Mitophagy Controls the Activities of Tumor Suppressor p53 to Regulate Hepatic Cancer Stem Cells”,,近日被國際知名雜志《Molecular Cell》(IF:14.7) 接收。
該論著由美國南加州大學KECK醫(yī)學院,、首都醫(yī)科大學附屬北京佑安醫(yī)院和北京市肝病研究所三家單位合作完成,,通信作者是James Ou教授,他是美國南加州大學KECK醫(yī)學院分子微生物學和免疫學系教授、北京市肝病研究所海聚人才,、臺灣中研院院士,。Ou教授團隊在HBV、HCV和自噬等研究領域都有著卓越成就,。在2014和2015年間,,Ou教授指導劉凱博士在其實驗室完成該研究的大部分實驗工作。2016年劉凱博士回國,,在Ou教授和陳德喜教授的指導下繼續(xù)完成該研究的剩余實驗工作,。
LCSCs是引起肝癌發(fā)生、發(fā)展和復發(fā)的關鍵因素之一,。該研究發(fā)現(xiàn)當p53的392位絲氨酸磷酸化后,,p-p53(S392)會直接與轉錄因子Nanog的啟動子結合而抑制Nanog的轉錄。Nanog的表達對于正常干細胞,、誘導多能干細胞和腫瘤干細胞的產生和功能發(fā)揮著重要作用,,因此p-p53(S392)通過抑制Nanog的表達可明顯抑制LCSCs的產生和功能。另外p-p53(S392)被發(fā)現(xiàn)可以定位在線粒體,,并且當線粒體自噬功能正常時,,線粒體自噬通過降解p-p53(S392)來調節(jié)p-p53(S392)的水平,從而間接地調節(jié)了LCSCs的產生和功能,。
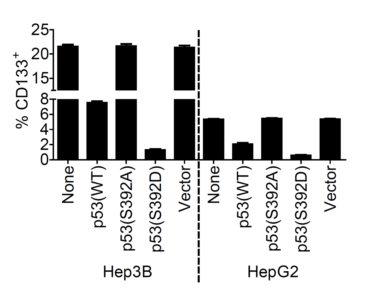
圖1. 過表達p-p53(S392)可明顯下調CD133+ LCSCs的水平
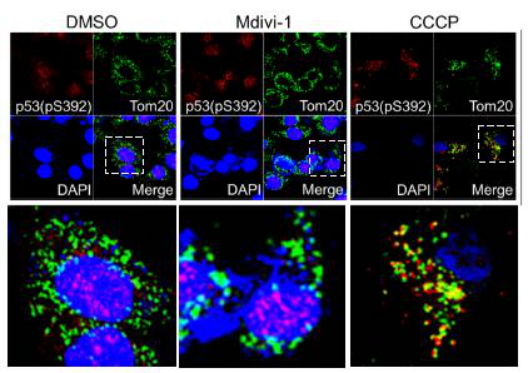
圖2. 促進線粒體自噬增加了p-p53(S392)與線粒體的結合,,從而導致p-p53(S392)被線粒體自噬降解增加
該研究的另一項重要發(fā)現(xiàn)是:激酶PINK1是磷酸化p53 S392位點的關鍵激酶。p53 S392位點磷酸化是激活p53,、促進其發(fā)揮生物學作用和減少自身降解的關鍵,,但是對p53 S392位點有明確磷酸化作用的激酶至今尚未有定論。因此該發(fā)現(xiàn)為后續(xù)深入研究p53的磷酸化,,尤其是S392位點的磷酸化提供了重要參考,。
綜上所述,該研究揭示了一個新的調控LCSCs產生的分子機制,,這將為肝癌分子機制的研究提供新的研究思路,。









 京公網(wǎng)安備11010602050066號
京公網(wǎng)安備11010602050066號



